曾永毅 傅俊 林孔英 郭洛彬 通信作者:曾永毅 福建医科大学孟超肝胆医院肝胆外科,福州 关 键 词
曾永毅 傅俊 林孔英 郭洛彬BQV帝国网站管理系统 通信作者:曾永毅BQV帝国网站管理系统 福建医科大学孟超肝胆医院肝胆外科,福州 BQV帝国网站管理系统 关 键 词BQV帝国网站管理系统 肝肿瘤;手术切除;局部治疗;靶向治疗;免疫治疗BQV帝国网站管理系统 BQV帝国网站管理系统
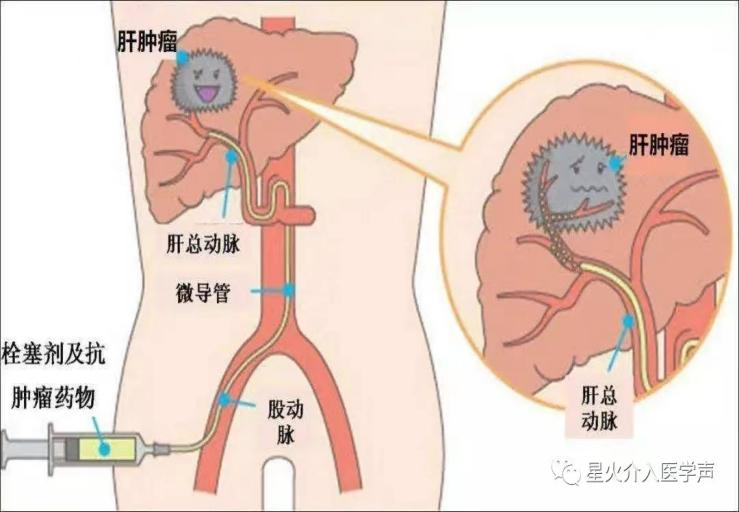
 肝动脉化疗栓塞术 (TACE) 治疗肝癌介绍
肝动脉化疗栓塞术 (TACE) 治疗肝癌介绍
 黄勇慧:介入治疗为什么是肝癌治疗的枢纽手段?...
黄勇慧:介入治疗为什么是肝癌治疗的枢纽手段?...
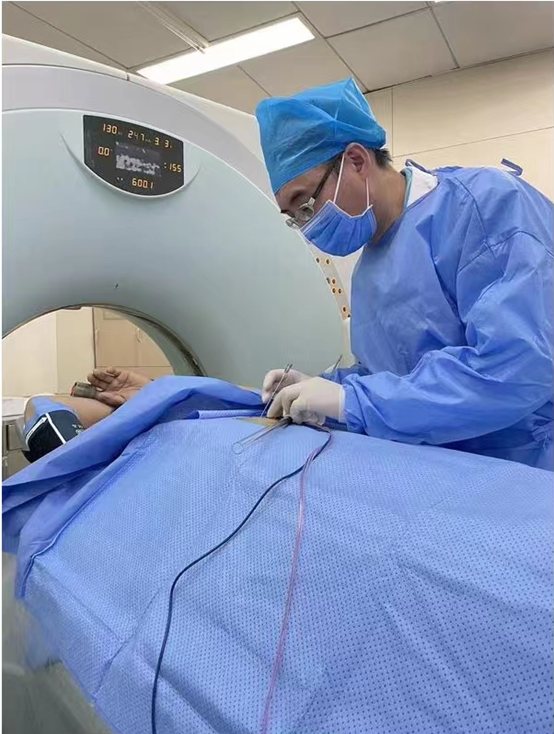
 李家平:如何通过介入方式治疗肝癌?
李家平:如何通过介入方式治疗肝癌?
 肝癌的放射治疗介绍
肝癌的放射治疗介绍
 精准打击肝癌细胞,堪称放疗界高配的质子疗法到底适用于哪些患者?...
精准打击肝癌细胞,堪称放疗界高配的质子疗法到底适用于哪些患者?...
 黎功主任:硼中子俘获疗法是一种什么技术,可以治疗肝癌吗?...
黎功主任:硼中子俘获疗法是一种什么技术,可以治疗肝癌吗?...
 鞠卫强:肝移植为什么能根治肝癌?
鞠卫强:肝移植为什么能根治肝癌?
 肝癌治疗的微创与精准化
肝癌治疗的微创与精准化
 腹腔镜肝癌切除:助力患者更快更好的康复
腹腔镜肝癌切除:助力患者更快更好的康复
 肝胆肿瘤中心: 肝癌早防早治是关键,综合治疗效果好...
肝胆肿瘤中心: 肝癌早防早治是关键,综合治疗效果好...
 百医百答|彭振维:肝癌,如何早发现早治疗?...
百医百答|彭振维:肝癌,如何早发现早治疗?...
 肝占位那些事
肝占位那些事
其他热门专题
 李绍强:为什么肝癌术后容易复发?
李绍强:为什么肝癌术后容易复发?
 肝癌介入栓塞治疗后需注意这个并发症
肝癌介入栓塞治疗后需注意这个并发症
 根治性切除术后辅助放疗可显著改善肝外胆管癌患者预后!...
根治性切除术后辅助放疗可显著改善肝外胆管癌患者预后!...
 肝动脉持续性灌注化疗(HAIC)健康教育
肝动脉持续性灌注化疗(HAIC)健康教育
 肝内胆管癌术后辅助治疗研究进展
肝内胆管癌术后辅助治疗研究进展
 肝癌术后如何选择药物?可以进行哪些辅助治疗?...
肝癌术后如何选择药物?可以进行哪些辅助治疗?...
 肝细胞癌术后辅助治疗的现状与展望——曾永毅 傅俊 林孔英等...
肝细胞癌术后辅助治疗的现状与展望——曾永毅 傅俊 林孔英等...
其他热门专题
 一针就能“刺死”肿瘤?肝癌消融治疗手术究竟有多神...
一针就能“刺死”肿瘤?肝癌消融治疗手术究竟有多神...
 根治肝癌有希望吗?这些新进展不得不知!
根治肝癌有希望吗?这些新进展不得不知!
 经血管介入,肝癌治疗的利器
经血管介入,肝癌治疗的利器
 介入治疗联合系统治疗在肝癌中的新进展
介入治疗联合系统治疗在肝癌中的新进展
 李绍强:为什么肝癌术后容易复发?
李绍强:为什么肝癌术后容易复发?
 肝癌介入栓塞治疗后需注意这个并发症
肝癌介入栓塞治疗后需注意这个并发症
 根治性切除术后辅助放疗可显著改善肝外胆管癌患者预后!...
根治性切除术后辅助放疗可显著改善肝外胆管癌患者预后!...
 肝内胆管癌患者长期生存的若干问题
肝内胆管癌患者长期生存的若干问题
 肝外胆管癌的介入治疗
肝外胆管癌的介入治疗
 肝内胆管癌术后辅助治疗研究进展
肝内胆管癌术后辅助治疗研究进展
其他热门专题
 介入治疗联合系统治疗在肝癌中的新进展
介入治疗联合系统治疗在肝癌中的新进展
 肝细胞癌术后辅助治疗的现状与展望——曾永毅 傅俊 林孔英等...
肝细胞癌术后辅助治疗的现状与展望——曾永毅 傅俊 林孔英等...
其他热门专题
 肝内胆管癌术后辅助治疗研究进展
肝内胆管癌术后辅助治疗研究进展
 肝癌术后如何选择药物?可以进行哪些辅助治疗?...
肝癌术后如何选择药物?可以进行哪些辅助治疗?...
 肝细胞癌术后辅助治疗的现状与展望——曾永毅 傅俊 林孔英等...
肝细胞癌术后辅助治疗的现状与展望——曾永毅 傅俊 林孔英等...
其他热门专题
 肝内胆管癌患者长期生存的若干问题
肝内胆管癌患者长期生存的若干问题
 目前最全肝内胆管癌治疗进展综述
目前最全肝内胆管癌治疗进展综述
 覃德龙|肝内胆管癌的诊治新进展
覃德龙|肝内胆管癌的诊治新进展
 肝细胞癌术后辅助治疗的现状与展望——曾永毅 傅俊 林孔英等...
肝细胞癌术后辅助治疗的现状与展望——曾永毅 傅俊 林孔英等...
其他热门专题
 出现这些症状,肝癌患者需小心谨“肾”!
出现这些症状,肝癌患者需小心谨“肾”!
 科学降温!2招击退肿瘤热!
科学降温!2招击退肿瘤热!
 史上最全的升白攻略!肝癌患者速速收藏!
史上最全的升白攻略!肝癌患者速速收藏!
 科普患教 | 胆道术后并发症及治疗
科普患教 | 胆道术后并发症及治疗
 肝癌患者 “夏日攻略”
肝癌患者 “夏日攻略”
 肝癌术后如何科学复查?
肝癌术后如何科学复查?
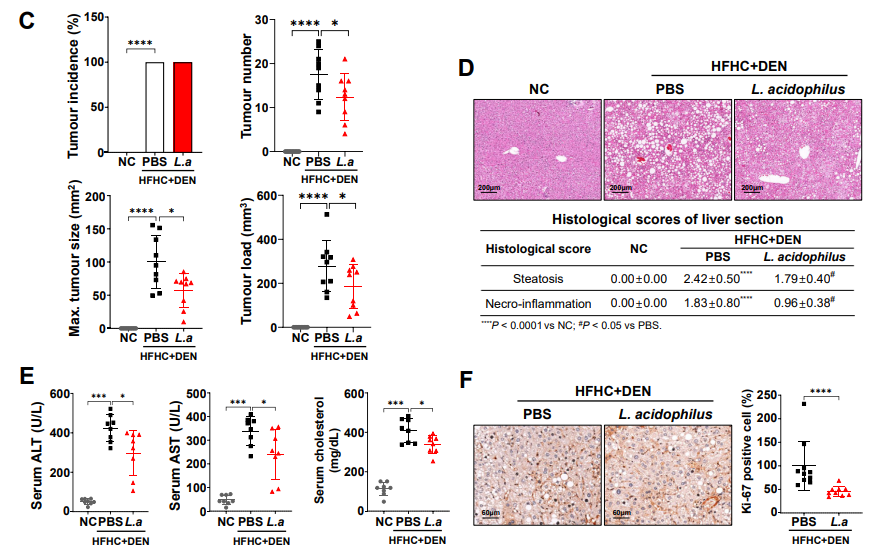 益生菌抗癌?柳叶刀子刊:补充这种益生菌,抑制肝癌,还改善肠道健康...
益生菌抗癌?柳叶刀子刊:补充这种益生菌,抑制肝癌,还改善肠道健康...
 胆道肿瘤患者的营养治疗共识
胆道肿瘤患者的营养治疗共识
 姜黄——一种天然的防治肝癌食品
姜黄——一种天然的防治肝癌食品
 生酮饮食治疗肝癌,靠谱吗?
生酮饮食治疗肝癌,靠谱吗?
其他肝癌护理专题
 复发?转移?原来影像学报告中早有“暗示”!...
复发?转移?原来影像学报告中早有“暗示”!...
 为什么肝功能检查正常,还会得肝癌?肝脏体检的所有秘密在这!...
为什么肝功能检查正常,还会得肝癌?肝脏体检的所有秘密在这!...
 体检发现肝占位一定是肝癌吗?应该怎么办?
体检发现肝占位一定是肝癌吗?应该怎么办?
 体检发现肝内占位,这种病千万不要漏诊!
体检发现肝内占位,这种病千万不要漏诊!
 小细针,大作用——超声引导下实体肿瘤穿刺活检技术...
小细针,大作用——超声引导下实体肿瘤穿刺活检技术...
 不用开刀就能确诊病理是一种什么体验?
不用开刀就能确诊病理是一种什么体验?
 一文读懂“肝癌”的病理报告
一文读懂“肝癌”的病理报告
 共识与指南│肝内胆管癌病理诊断专家共识(2022版)...
共识与指南│肝内胆管癌病理诊断专家共识(2022版)...
 中国人的肝癌诱因正在改变!脂肪肝成为潜在“杀手”...
中国人的肝癌诱因正在改变!脂肪肝成为潜在“杀手”...
 多达1/3脂肪肝可发展为肝硬化或肝癌!最新指南带来有效治疗的3大策...
多达1/3脂肪肝可发展为肝硬化或肝癌!最新指南带来有效治疗的3大策...
 90斤素食女孩竟然查出脂肪肝?!离肝癌只有4步之遥...
90斤素食女孩竟然查出脂肪肝?!离肝癌只有4步之遥...
 华赟鹏:脂肪肝可逆吗?得了肝癌还能治吗?
华赟鹏:脂肪肝可逆吗?得了肝癌还能治吗?
 肝癌三项,助力肝癌早诊早治!
肝癌三项,助力肝癌早诊早治!
 抽管血就能早筛肝癌?国际专家谈液体活检新进展...
抽管血就能早筛肝癌?国际专家谈液体活检新进展...
 肝功能正常,却突然查出肝癌晚期!医生说出真相...
肝功能正常,却突然查出肝癌晚期!医生说出真相...
其他诊断筛查专题
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 西南医院
重庆
西南医院
重庆
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 南京鼓楼医院
南京
南京鼓楼医院
南京
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 中国科学技术大学附属第一医院
合肥
中国科学技术大学附属第一医院
合肥
第95名 综合排名
 山东大学齐鲁医院
济南
山东大学齐鲁医院
济南
第24名 综合排名
 南京市胸科医院
南京
南京市胸科医院
南京
 四川省肿瘤医院
成都
四川省肿瘤医院
成都
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 新桥医院
重庆
新桥医院
重庆
 山东省立医院
济南
山东省立医院
济南
第52名 综合排名
 广东省中医院
广州
广东省中医院
广州
 上海长征医院
上海
上海长征医院
上海
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 哈尔滨医科大学附属第一医院
哈尔滨
哈尔滨医科大学附属第一医院
哈尔滨
第78名 综合排名
 东部战区总医院
南京
东部战区总医院
南京
第58名 综合排名
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 苏州大学附属第一医院
苏州
苏州大学附属第一医院
苏州
第54名 综合排名
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 上海市胸科医院
上海
上海市胸科医院
上海
第80名 综合排名
 上海市东方医院
上海
上海市东方医院
上海
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 武汉大学人民医院
武汉
武汉大学人民医院
武汉
第40名 综合排名
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 中国科学技术大学附属第一医院
合肥
中国科学技术大学附属第一医院
合肥
第95名 综合排名
 深圳市第三人民医院
深圳
深圳市第三人民医院
深圳
 辽宁省肿瘤医院
沈阳
辽宁省肿瘤医院
沈阳
 南京市胸科医院
南京
南京市胸科医院
南京
 广东省人民医院
广州
广东省人民医院
广州
第34名 综合排名
 四川省肿瘤医院
成都
四川省肿瘤医院
成都
 复旦大学附属妇产科医院
上海
复旦大学附属妇产科医院
上海
第85名 综合排名
 中日友好医院
北京
中日友好医院
北京
第43名 综合排名
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 浙江大学医学院附属妇产科医院
杭州
浙江大学医学院附属妇产科医院
杭州
第91名 综合排名
 广东省中医院
广州
广东省中医院
广州
 山东省立医院
济南
山东省立医院
济南
第52名 综合排名
 上海长征医院
上海
上海长征医院
上海
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 中山大学孙逸仙纪念医院
广州
中山大学孙逸仙纪念医院
广州
第64名 综合排名
 东部战区总医院
南京
东部战区总医院
南京
第58名 综合排名
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 北京京西肿瘤医院
北京
北京京西肿瘤医院
北京
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 上海市胸科医院
上海
上海市胸科医院
上海
第80名 综合排名
 湖南省肿瘤医院
长沙
湖南省肿瘤医院
长沙
 华中科技大学同济医院
武汉
华中科技大学同济医院
武汉
 中国医科大学附属盛京医院
沈阳
中国医科大学附属盛京医院
沈阳
第33名 综合排名
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 复旦大学附属华山医院
上海
复旦大学附属华山医院
上海
第8名 综合排名
 上海市东方医院
上海
上海市东方医院
上海
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 中国科学技术大学附属第一医院
合肥
中国科学技术大学附属第一医院
合肥
第95名 综合排名
 山东大学齐鲁医院
济南
山东大学齐鲁医院
济南
第24名 综合排名
 吉林省肿瘤医院
长春
吉林省肿瘤医院
长春
 杭州市肿瘤医院
杭州
杭州市肿瘤医院
杭州
 深圳市第三人民医院
深圳
深圳市第三人民医院
深圳
 辽宁省肿瘤医院
沈阳
辽宁省肿瘤医院
沈阳
 南京市胸科医院
南京
南京市胸科医院
南京
 广东省人民医院
广州
广东省人民医院
广州
第34名 综合排名
 复旦大学附属妇产科医院
上海
复旦大学附属妇产科医院
上海
第85名 综合排名
 中日友好医院
北京
中日友好医院
北京
第43名 综合排名
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 西南医院
重庆
西南医院
重庆
 北部战区总医院
沈阳
北部战区总医院
沈阳
 浙江大学医学院附属妇产科医院
杭州
浙江大学医学院附属妇产科医院
杭州
第91名 综合排名
 广东省中医院
广州
广东省中医院
广州
 山东省立医院
济南
山东省立医院
济南
第52名 综合排名
 武汉大学中南医院
武汉
武汉大学中南医院
武汉
第55名 综合排名
 哈尔滨医科大学附属第二医院
哈尔滨
哈尔滨医科大学附属第二医院
哈尔滨
第67名 综合排名
 重庆医科大学附属第一医院
重庆
重庆医科大学附属第一医院
重庆
第48名 综合排名
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 中山大学孙逸仙纪念医院
广州
中山大学孙逸仙纪念医院
广州
第64名 综合排名
 新桥医院
重庆
新桥医院
重庆
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 301医院
北京
301医院
北京
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 苏州大学附属第一医院
苏州
苏州大学附属第一医院
苏州
第54名 综合排名
 武汉大学人民医院
武汉
武汉大学人民医院
武汉
第40名 综合排名
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 上海市第十人民医院
上海
上海市第十人民医院
上海
 浙江省肿瘤医院
杭州
浙江省肿瘤医院
杭州
第8名 肿瘤科排名
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 上海交通大学医学院附属仁济医院
上海
上海交通大学医学院附属仁济医院
上海
第17名 综合排名
 复旦大学附属中山医院
上海
复旦大学附属中山医院
上海
第5名 综合排名
 北京京西肿瘤医院
北京
北京京西肿瘤医院
北京
 江苏省肿瘤医院
南京
江苏省肿瘤医院
南京
第9名 肿瘤科排名
 上海市胸科医院
上海
上海市胸科医院
上海
第80名 综合排名
 湖南省肿瘤医院
长沙
湖南省肿瘤医院
长沙
 中山大学附属第一医院
广州
中山大学附属第一医院
广州
第9名 综合排名
 北京医院
北京
北京医院
北京
第60名 综合排名
 华中科技大学同济医院
武汉
华中科技大学同济医院
武汉
 浙江大学医学院附属第一医院
杭州
浙江大学医学院附属第一医院
杭州
第10名 综合排名
 湖北省肿瘤医院
武汉
湖北省肿瘤医院
武汉
 中国医科大学附属盛京医院
沈阳
中国医科大学附属盛京医院
沈阳
第33名 综合排名
 浙大二院
杭州
浙大二院
杭州
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 河南省肿瘤医院
郑州
河南省肿瘤医院
郑州
 上海长海医院
上海
上海长海医院
上海
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 浙江大学医学院附属邵逸夫医院
杭州
浙江大学医学院附属邵逸夫医院
杭州
第49名 综合排名
 复旦大学附属华山医院
上海
复旦大学附属华山医院
上海
第8名 综合排名
 上海市东方医院
上海
上海市东方医院
上海
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 吉林省肿瘤医院
长春
吉林省肿瘤医院
长春
 杭州市肿瘤医院
杭州
杭州市肿瘤医院
杭州
 南京市胸科医院
南京
南京市胸科医院
南京
 中国科学技术大学附属第一医院
合肥
中国科学技术大学附属第一医院
合肥
第95名 综合排名
 西安交通大学第一附属医院
西安
西安交通大学第一附属医院
西安
第63名 综合排名
 深圳市第三人民医院
深圳
深圳市第三人民医院
深圳
 山西省肿瘤医院
太原
山西省肿瘤医院
太原
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 广东省人民医院
广州
广东省人民医院
广州
第34名 综合排名
 复旦大学附属妇产科医院
上海
复旦大学附属妇产科医院
上海
第85名 综合排名
 中日友好医院
北京
中日友好医院
北京
第43名 综合排名
 中山大学附属第三医院
广州
中山大学附属第三医院
广州
第45名 综合排名
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 北部战区总医院
沈阳
北部战区总医院
沈阳
 浙江大学医学院附属妇产科医院
杭州
浙江大学医学院附属妇产科医院
杭州
第91名 综合排名
 广东省中医院
广州
广东省中医院
广州
 山东省立医院
济南
山东省立医院
济南
第52名 综合排名
 武汉大学中南医院
武汉
武汉大学中南医院
武汉
第55名 综合排名
 上海长征医院
上海
上海长征医院
上海
 重庆医科大学附属第一医院
重庆
重庆医科大学附属第一医院
重庆
第48名 综合排名
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 福建医科大学附属第一医院
福州
福建医科大学附属第一医院
福州
第84名 综合排名
 新桥医院
重庆
新桥医院
重庆
 东部战区总医院
南京
东部战区总医院
南京
第58名 综合排名
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 301医院
北京
301医院
北京
 东南大学附属中大医院
南京
东南大学附属中大医院
南京
第46名 综合排名
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 苏州大学附属第一医院
苏州
苏州大学附属第一医院
苏州
第54名 综合排名
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 上海市第十人民医院
上海
上海市第十人民医院
上海
 浙江省肿瘤医院
杭州
浙江省肿瘤医院
杭州
第8名 肿瘤科排名
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 北京医院
北京
北京医院
北京
第60名 综合排名
 上海交通大学医学院附属仁济医院
上海
上海交通大学医学院附属仁济医院
上海
第17名 综合排名
 复旦大学附属中山医院
上海
复旦大学附属中山医院
上海
第5名 综合排名
 北京京西肿瘤医院
北京
北京京西肿瘤医院
北京
 上海市胸科医院
上海
上海市胸科医院
上海
第80名 综合排名
 湖南省肿瘤医院
长沙
湖南省肿瘤医院
长沙
 上海新华医院
上海
上海新华医院
上海
 华中科技大学同济医院
武汉
华中科技大学同济医院
武汉
 上海市东方医院
上海
上海市东方医院
上海
 浙大二院
杭州
浙大二院
杭州
 浙江大学医学院附属第一医院
杭州
浙江大学医学院附属第一医院
杭州
第10名 综合排名
 湖北省肿瘤医院
武汉
湖北省肿瘤医院
武汉
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 河南省肿瘤医院
郑州
河南省肿瘤医院
郑州
 武汉大学人民医院
武汉
武汉大学人民医院
武汉
第40名 综合排名
 中国医科大学附属盛京医院
沈阳
中国医科大学附属盛京医院
沈阳
第33名 综合排名
 上海长海医院
上海
上海长海医院
上海
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 复旦大学附属华山医院
上海
复旦大学附属华山医院
上海
第8名 综合排名
 广州泰和肿瘤医院
广州
广州泰和肿瘤医院
广州
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 山东大学齐鲁医院
济南
山东大学齐鲁医院
济南
第24名 综合排名
 吉林省肿瘤医院
长春
吉林省肿瘤医院
长春
 南京市胸科医院
南京
南京市胸科医院
南京
 中国科学技术大学附属第一医院
合肥
中国科学技术大学附属第一医院
合肥
第95名 综合排名
 深圳市第三人民医院
深圳
深圳市第三人民医院
深圳
 山西省肿瘤医院
太原
山西省肿瘤医院
太原
 辽宁省肿瘤医院
沈阳
辽宁省肿瘤医院
沈阳
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 广东省人民医院
广州
广东省人民医院
广州
第34名 综合排名
 中日友好医院
北京
中日友好医院
北京
第43名 综合排名
 中山大学附属第三医院
广州
中山大学附属第三医院
广州
第45名 综合排名
 西南医院
重庆
西南医院
重庆
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 北部战区总医院
沈阳
北部战区总医院
沈阳
 浙江大学医学院附属妇产科医院
杭州
浙江大学医学院附属妇产科医院
杭州
第91名 综合排名
 山东省立医院
济南
山东省立医院
济南
第52名 综合排名
 武汉大学中南医院
武汉
武汉大学中南医院
武汉
第55名 综合排名
 广东省中医院
广州
广东省中医院
广州
 上海长征医院
上海
上海长征医院
上海
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 重庆医科大学附属第一医院
重庆
重庆医科大学附属第一医院
重庆
第48名 综合排名
 福建医科大学附属协和医院
福州
福建医科大学附属协和医院
福州
第88名 综合排名
 广州医科大学附属第一医院
广州
广州医科大学附属第一医院
广州
第31名 综合排名
 中山大学孙逸仙纪念医院
广州
中山大学孙逸仙纪念医院
广州
第64名 综合排名
 福建医科大学附属第一医院
福州
福建医科大学附属第一医院
福州
第84名 综合排名
 新桥医院
重庆
新桥医院
重庆
 东部战区总医院
南京
东部战区总医院
南京
第58名 综合排名
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 301医院
北京
301医院
北京
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 苏州大学附属第一医院
苏州
苏州大学附属第一医院
苏州
第54名 综合排名
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 上海市第十人民医院
上海
上海市第十人民医院
上海
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 北京医院
北京
北京医院
北京
第60名 综合排名
 上海交通大学医学院附属仁济医院
上海
上海交通大学医学院附属仁济医院
上海
第17名 综合排名
 复旦大学附属中山医院
上海
复旦大学附属中山医院
上海
第5名 综合排名
 北京京西肿瘤医院
北京
北京京西肿瘤医院
北京
 江苏省肿瘤医院
南京
江苏省肿瘤医院
南京
第9名 肿瘤科排名
 上海交通大学医学院附属瑞金医院
上海
上海交通大学医学院附属瑞金医院
上海
第4名 综合排名
 上海市胸科医院
上海
上海市胸科医院
上海
第80名 综合排名
 湖南省肿瘤医院
长沙
湖南省肿瘤医院
长沙
 上海新华医院
上海
上海新华医院
上海
 中山大学附属第一医院
广州
中山大学附属第一医院
广州
第9名 综合排名
 华中科技大学同济医院
武汉
华中科技大学同济医院
武汉
 浙江大学医学院附属第一医院
杭州
浙江大学医学院附属第一医院
杭州
第10名 综合排名
 浙大二院
杭州
浙大二院
杭州
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 武汉大学人民医院
武汉
武汉大学人民医院
武汉
第40名 综合排名
 河南省肿瘤医院
郑州
河南省肿瘤医院
郑州
 上海长海医院
上海
上海长海医院
上海
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 浙江大学医学院附属邵逸夫医院
杭州
浙江大学医学院附属邵逸夫医院
杭州
第49名 综合排名
 复旦大学附属华山医院
上海
复旦大学附属华山医院
上海
第8名 综合排名
 广州泰和肿瘤医院
广州
广州泰和肿瘤医院
广州
 上海市东方医院
上海
上海市东方医院
上海
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 山东大学齐鲁医院
济南
山东大学齐鲁医院
济南
第24名 综合排名
 吉林省肿瘤医院
长春
吉林省肿瘤医院
长春
 杭州市肿瘤医院
杭州
杭州市肿瘤医院
杭州
 南京市胸科医院
南京
南京市胸科医院
南京
 中国科学技术大学附属第一医院
合肥
中国科学技术大学附属第一医院
合肥
第95名 综合排名
 深圳市第三人民医院
深圳
深圳市第三人民医院
深圳
 山西省肿瘤医院
太原
山西省肿瘤医院
太原
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 广东省人民医院
广州
广东省人民医院
广州
第34名 综合排名
 四川省肿瘤医院
成都
四川省肿瘤医院
成都
 复旦大学附属妇产科医院
上海
复旦大学附属妇产科医院
上海
第85名 综合排名
 中日友好医院
北京
中日友好医院
北京
第43名 综合排名
 中山大学附属第三医院
广州
中山大学附属第三医院
广州
第45名 综合排名
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 北部战区总医院
沈阳
北部战区总医院
沈阳
 浙江大学医学院附属妇产科医院
杭州
浙江大学医学院附属妇产科医院
杭州
第91名 综合排名
 山东省立医院
济南
山东省立医院
济南
第52名 综合排名
 武汉大学中南医院
武汉
武汉大学中南医院
武汉
第55名 综合排名
 四川省人民医院
成都
四川省人民医院
成都
第38名 综合排名
 上海长征医院
上海
上海长征医院
上海
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 重庆医科大学附属第一医院
重庆
重庆医科大学附属第一医院
重庆
第48名 综合排名
 中山大学孙逸仙纪念医院
广州
中山大学孙逸仙纪念医院
广州
第64名 综合排名
 哈尔滨医科大学附属第一医院
哈尔滨
哈尔滨医科大学附属第一医院
哈尔滨
第78名 综合排名
 福建医科大学附属第一医院
福州
福建医科大学附属第一医院
福州
第84名 综合排名
 新桥医院
重庆
新桥医院
重庆
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 301医院
北京
301医院
北京
 东南大学附属中大医院
南京
东南大学附属中大医院
南京
第46名 综合排名
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 上海市第十人民医院
上海
上海市第十人民医院
上海
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 北京医院
北京
北京医院
北京
第60名 综合排名
 上海交通大学医学院附属仁济医院
上海
上海交通大学医学院附属仁济医院
上海
第17名 综合排名
 复旦大学附属中山医院
上海
复旦大学附属中山医院
上海
第5名 综合排名
 北京京西肿瘤医院
北京
北京京西肿瘤医院
北京
 上海交通大学医学院附属瑞金医院
上海
上海交通大学医学院附属瑞金医院
上海
第4名 综合排名
 上海市胸科医院
上海
上海市胸科医院
上海
第80名 综合排名
 湖南省肿瘤医院
长沙
湖南省肿瘤医院
长沙
 上海新华医院
上海
上海新华医院
上海
 中山大学附属第一医院
广州
中山大学附属第一医院
广州
第9名 综合排名
 华中科技大学同济医院
武汉
华中科技大学同济医院
武汉
 湖北省肿瘤医院
武汉
湖北省肿瘤医院
武汉
 中国医科大学附属盛京医院
沈阳
中国医科大学附属盛京医院
沈阳
第33名 综合排名
 浙大二院
杭州
浙大二院
杭州
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 武汉大学人民医院
武汉
武汉大学人民医院
武汉
第40名 综合排名
 河南省肿瘤医院
郑州
河南省肿瘤医院
郑州
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 复旦大学附属华山医院
上海
复旦大学附属华山医院
上海
第8名 综合排名
 广州泰和肿瘤医院
广州
广州泰和肿瘤医院
广州
 上海市东方医院
上海
上海市东方医院
上海
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 西安交通大学第一附属医院
西安
西安交通大学第一附属医院
西安
第63名 综合排名
 吉林省肿瘤医院
长春
吉林省肿瘤医院
长春
 辽宁省肿瘤医院
沈阳
辽宁省肿瘤医院
沈阳
 浙江大学医学院附属妇产科医院
杭州
浙江大学医学院附属妇产科医院
杭州
第91名 综合排名
 北部战区总医院
沈阳
北部战区总医院
沈阳
 山西省肿瘤医院
太原
山西省肿瘤医院
太原
 杭州市肿瘤医院
杭州
杭州市肿瘤医院
杭州
 南京市胸科医院
南京
南京市胸科医院
南京
 中日友好医院
北京
中日友好医院
北京
第43名 综合排名
 广东省人民医院
广州
广东省人民医院
广州
第34名 综合排名
 四川省肿瘤医院
成都
四川省肿瘤医院
成都
 中山大学附属第三医院
广州
中山大学附属第三医院
广州
第45名 综合排名
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 西南医院
重庆
西南医院
重庆
 新桥医院
重庆
新桥医院
重庆
 广东省中医院
广州
广东省中医院
广州
 山东省立医院
济南
山东省立医院
济南
第52名 综合排名
 武汉大学中南医院
武汉
武汉大学中南医院
武汉
第55名 综合排名
 上海长征医院
上海
上海长征医院
上海
 厦门大学附属第一医院
厦门
厦门大学附属第一医院
厦门
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 重庆医科大学附属第一医院
重庆
重庆医科大学附属第一医院
重庆
第48名 综合排名
 四川省人民医院
成都
四川省人民医院
成都
第38名 综合排名
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 东部战区总医院
南京
东部战区总医院
南京
第58名 综合排名
 哈尔滨医科大学附属第一医院
哈尔滨
哈尔滨医科大学附属第一医院
哈尔滨
第78名 综合排名
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 复旦大学附属妇产科医院
上海
复旦大学附属妇产科医院
上海
第85名 综合排名
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 上海市第十人民医院
上海
上海市第十人民医院
上海
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 华中科技大学同济医院
武汉
华中科技大学同济医院
武汉
 北京医院
北京
北京医院
北京
第60名 综合排名
 上海交通大学医学院附属仁济医院
上海
上海交通大学医学院附属仁济医院
上海
第17名 综合排名
 北京京西肿瘤医院
北京
北京京西肿瘤医院
北京
 上海市胸科医院
上海
上海市胸科医院
上海
第80名 综合排名
 湖南省肿瘤医院
长沙
湖南省肿瘤医院
长沙
 上海新华医院
上海
上海新华医院
上海
 江苏省肿瘤医院
南京
江苏省肿瘤医院
南京
第9名 肿瘤科排名
 南方医科大学南方医院
广州
南方医科大学南方医院
广州
第18名 综合排名
 上海市东方医院
上海
上海市东方医院
上海
 浙江大学医学院附属第一医院
杭州
浙江大学医学院附属第一医院
杭州
第10名 综合排名
 湖北省肿瘤医院
武汉
湖北省肿瘤医院
武汉
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 河南省肿瘤医院
郑州
河南省肿瘤医院
郑州
 苏州大学附属第一医院
苏州
苏州大学附属第一医院
苏州
第54名 综合排名
 武汉大学人民医院
武汉
武汉大学人民医院
武汉
第40名 综合排名
 中国医科大学附属盛京医院
沈阳
中国医科大学附属盛京医院
沈阳
第33名 综合排名
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 复旦大学附属华山医院
上海
复旦大学附属华山医院
上海
第8名 综合排名
 广州泰和肿瘤医院
广州
广州泰和肿瘤医院
广州
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 西安交通大学第一附属医院
西安
西安交通大学第一附属医院
西安
第63名 综合排名
 中国科学技术大学附属第一医院
合肥
中国科学技术大学附属第一医院
合肥
第95名 综合排名
 山东大学齐鲁医院
济南
山东大学齐鲁医院
济南
第24名 综合排名
 吉林省肿瘤医院
长春
吉林省肿瘤医院
长春
 辽宁省肿瘤医院
沈阳
辽宁省肿瘤医院
沈阳
 浙江大学医学院附属妇产科医院
杭州
浙江大学医学院附属妇产科医院
杭州
第91名 综合排名
 北部战区总医院
沈阳
北部战区总医院
沈阳
 深圳市第三人民医院
深圳
深圳市第三人民医院
深圳
 山西省肿瘤医院
太原
山西省肿瘤医院
太原
 杭州市肿瘤医院
杭州
杭州市肿瘤医院
杭州
 南京市胸科医院
南京
南京市胸科医院
南京
 中日友好医院
北京
中日友好医院
北京
第43名 综合排名
 福建省肿瘤医院
福州
福建省肿瘤医院
福州
 广东省人民医院
广州
广东省人民医院
广州
第34名 综合排名
 四川省肿瘤医院
成都
四川省肿瘤医院
成都
 中山大学附属第三医院
广州
中山大学附属第三医院
广州
第45名 综合排名
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 西南医院
重庆
西南医院
重庆
 新桥医院
重庆
新桥医院
重庆
 福建医科大学附属第一医院
福州
福建医科大学附属第一医院
福州
第84名 综合排名
 广东省中医院
广州
广东省中医院
广州
 山东省立医院
济南
山东省立医院
济南
第52名 综合排名
 武汉大学中南医院
武汉
武汉大学中南医院
武汉
第55名 综合排名
 中南大学湘雅二医院
长沙
中南大学湘雅二医院
长沙
第20名 综合排名
 上海长征医院
上海
上海长征医院
上海
 厦门大学附属第一医院
厦门
厦门大学附属第一医院
厦门
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 重庆医科大学附属第一医院
重庆
重庆医科大学附属第一医院
重庆
第48名 综合排名
 四川省人民医院
成都
四川省人民医院
成都
第38名 综合排名
 哈尔滨医科大学附属第二医院
哈尔滨
哈尔滨医科大学附属第二医院
哈尔滨
第67名 综合排名
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 东部战区总医院
南京
东部战区总医院
南京
第58名 综合排名
 中山大学孙逸仙纪念医院
广州
中山大学孙逸仙纪念医院
广州
第64名 综合排名
 哈尔滨医科大学附属第一医院
哈尔滨
哈尔滨医科大学附属第一医院
哈尔滨
第78名 综合排名
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 东南大学附属中大医院
南京
东南大学附属中大医院
南京
第46名 综合排名
 福建医科大学附属协和医院
福州
福建医科大学附属协和医院
福州
第88名 综合排名
 广州医科大学附属第一医院
广州
广州医科大学附属第一医院
广州
第31名 综合排名
 301医院
北京
301医院
北京
 复旦大学附属妇产科医院
上海
复旦大学附属妇产科医院
上海
第85名 综合排名
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 上海市第十人民医院
上海
上海市第十人民医院
上海
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 复旦大学附属中山医院
上海
复旦大学附属中山医院
上海
第5名 综合排名
 华中科技大学同济医院
武汉
华中科技大学同济医院
武汉
 北京医院
北京
北京医院
北京
第60名 综合排名
 上海交通大学医学院附属仁济医院
上海
上海交通大学医学院附属仁济医院
上海
第17名 综合排名
 浙江省肿瘤医院
杭州
浙江省肿瘤医院
杭州
第8名 肿瘤科排名
 北京京西肿瘤医院
北京
北京京西肿瘤医院
北京
 上海交通大学医学院附属瑞金医院
上海
上海交通大学医学院附属瑞金医院
上海
第4名 综合排名
 上海市胸科医院
上海
上海市胸科医院
上海
第80名 综合排名
 湖南省肿瘤医院
长沙
湖南省肿瘤医院
长沙
 上海新华医院
上海
上海新华医院
上海
 江苏省肿瘤医院
南京
江苏省肿瘤医院
南京
第9名 肿瘤科排名
 中山大学附属第一医院
广州
中山大学附属第一医院
广州
第9名 综合排名
 南方医科大学南方医院
广州
南方医科大学南方医院
广州
第18名 综合排名
 上海市东方医院
上海
上海市东方医院
上海
 浙大二院
杭州
浙大二院
杭州
 浙江大学医学院附属第一医院
杭州
浙江大学医学院附属第一医院
杭州
第10名 综合排名
 湖北省肿瘤医院
武汉
湖北省肿瘤医院
武汉
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 河南省肿瘤医院
郑州
河南省肿瘤医院
郑州
 武汉大学人民医院
武汉
武汉大学人民医院
武汉
第40名 综合排名
 中国医科大学附属盛京医院
沈阳
中国医科大学附属盛京医院
沈阳
第33名 综合排名
 上海长海医院
上海
上海长海医院
上海
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 浙江大学医学院附属邵逸夫医院
杭州
浙江大学医学院附属邵逸夫医院
杭州
第49名 综合排名
 复旦大学附属华山医院
上海
复旦大学附属华山医院
上海
第8名 综合排名
 广州泰和肿瘤医院
广州
广州泰和肿瘤医院
广州
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 中国科学技术大学附属第一医院
合肥
中国科学技术大学附属第一医院
合肥
第95名 综合排名
 吉林省肿瘤医院
长春
吉林省肿瘤医院
长春
 浙江大学医学院附属妇产科医院
杭州
浙江大学医学院附属妇产科医院
杭州
第91名 综合排名
 北部战区总医院
沈阳
北部战区总医院
沈阳
 深圳市第三人民医院
深圳
深圳市第三人民医院
深圳
 山西省肿瘤医院
太原
山西省肿瘤医院
太原
 杭州市肿瘤医院
杭州
杭州市肿瘤医院
杭州
 南京市胸科医院
南京
南京市胸科医院
南京
 中日友好医院
北京
中日友好医院
北京
第43名 综合排名
 广东省人民医院
广州
广东省人民医院
广州
第34名 综合排名
 四川省肿瘤医院
成都
四川省肿瘤医院
成都
 中山大学附属第三医院
广州
中山大学附属第三医院
广州
第45名 综合排名
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 西南医院
重庆
西南医院
重庆
 新桥医院
重庆
新桥医院
重庆
 广东省中医院
广州
广东省中医院
广州
 山东省立医院
济南
山东省立医院
济南
第52名 综合排名
 武汉大学中南医院
武汉
武汉大学中南医院
武汉
第55名 综合排名
 中南大学湘雅二医院
长沙
中南大学湘雅二医院
长沙
第20名 综合排名
 上海长征医院
上海
上海长征医院
上海
 厦门大学附属第一医院
厦门
厦门大学附属第一医院
厦门
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 重庆医科大学附属第一医院
重庆
重庆医科大学附属第一医院
重庆
第48名 综合排名
 四川省人民医院
成都
四川省人民医院
成都
第38名 综合排名
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 东部战区总医院
南京
东部战区总医院
南京
第58名 综合排名
 中山大学孙逸仙纪念医院
广州
中山大学孙逸仙纪念医院
广州
第64名 综合排名
 哈尔滨医科大学附属第一医院
哈尔滨
哈尔滨医科大学附属第一医院
哈尔滨
第78名 综合排名
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 301医院
北京
301医院
北京
 复旦大学附属妇产科医院
上海
复旦大学附属妇产科医院
上海
第85名 综合排名
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 上海市第十人民医院
上海
上海市第十人民医院
上海
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 复旦大学附属中山医院
上海
复旦大学附属中山医院
上海
第5名 综合排名
 华中科技大学同济医院
武汉
华中科技大学同济医院
武汉
 北京医院
北京
北京医院
北京
第60名 综合排名
 上海交通大学医学院附属仁济医院
上海
上海交通大学医学院附属仁济医院
上海
第17名 综合排名
 北京京西肿瘤医院
北京
北京京西肿瘤医院
北京
 上海交通大学医学院附属瑞金医院
上海
上海交通大学医学院附属瑞金医院
上海
第4名 综合排名
 湖南省肿瘤医院
长沙
湖南省肿瘤医院
长沙
 上海新华医院
上海
上海新华医院
上海
 江苏省肿瘤医院
南京
江苏省肿瘤医院
南京
第9名 肿瘤科排名
 中山大学附属第一医院
广州
中山大学附属第一医院
广州
第9名 综合排名
 南方医科大学南方医院
广州
南方医科大学南方医院
广州
第18名 综合排名
 上海市东方医院
上海
上海市东方医院
上海
 浙大二院
杭州
浙大二院
杭州
 浙江大学医学院附属第一医院
杭州
浙江大学医学院附属第一医院
杭州
第10名 综合排名
 湖北省肿瘤医院
武汉
湖北省肿瘤医院
武汉
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 河南省肿瘤医院
郑州
河南省肿瘤医院
郑州
 苏州大学附属第一医院
苏州
苏州大学附属第一医院
苏州
第54名 综合排名
 武汉大学人民医院
武汉
武汉大学人民医院
武汉
第40名 综合排名
 中国医科大学附属盛京医院
沈阳
中国医科大学附属盛京医院
沈阳
第33名 综合排名
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 复旦大学附属华山医院
上海
复旦大学附属华山医院
上海
第8名 综合排名
 广州泰和肿瘤医院
广州
广州泰和肿瘤医院
广州
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 西安交通大学第一附属医院
西安
西安交通大学第一附属医院
西安
第63名 综合排名
 中国科学技术大学附属第一医院
合肥
中国科学技术大学附属第一医院
合肥
第95名 综合排名
 吉林省肿瘤医院
长春
吉林省肿瘤医院
长春
 辽宁省肿瘤医院
沈阳
辽宁省肿瘤医院
沈阳
 浙江大学医学院附属妇产科医院
杭州
浙江大学医学院附属妇产科医院
杭州
第91名 综合排名
 深圳市第三人民医院
深圳
深圳市第三人民医院
深圳
 山西省肿瘤医院
太原
山西省肿瘤医院
太原
 杭州市肿瘤医院
杭州
杭州市肿瘤医院
杭州
 南京市胸科医院
南京
南京市胸科医院
南京
 中日友好医院
北京
中日友好医院
北京
第43名 综合排名
 福建省肿瘤医院
福州
福建省肿瘤医院
福州
 广东省人民医院
广州
广东省人民医院
广州
第34名 综合排名
 四川省肿瘤医院
成都
四川省肿瘤医院
成都
 中山大学附属第三医院
广州
中山大学附属第三医院
广州
第45名 综合排名
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 福建医科大学附属第一医院
福州
福建医科大学附属第一医院
福州
第84名 综合排名
 广东省中医院
广州
广东省中医院
广州
 山东省立医院
济南
山东省立医院
济南
第52名 综合排名
 武汉大学中南医院
武汉
武汉大学中南医院
武汉
第55名 综合排名
 上海长征医院
上海
上海长征医院
上海
 厦门大学附属第一医院
厦门
厦门大学附属第一医院
厦门
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 重庆医科大学附属第一医院
重庆
重庆医科大学附属第一医院
重庆
第48名 综合排名
 中南大学湘雅二医院
长沙
中南大学湘雅二医院
长沙
第20名 综合排名
 四川省人民医院
成都
四川省人民医院
成都
第38名 综合排名
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 东部战区总医院
南京
东部战区总医院
南京
第58名 综合排名
 中山大学孙逸仙纪念医院
广州
中山大学孙逸仙纪念医院
广州
第64名 综合排名
 哈尔滨医科大学附属第一医院
哈尔滨
哈尔滨医科大学附属第一医院
哈尔滨
第78名 综合排名
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 东南大学附属中大医院
南京
东南大学附属中大医院
南京
第46名 综合排名
 哈尔滨医科大学附属第二医院
哈尔滨
哈尔滨医科大学附属第二医院
哈尔滨
第67名 综合排名
 复旦大学附属妇产科医院
上海
复旦大学附属妇产科医院
上海
第85名 综合排名
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 上海市第十人民医院
上海
上海市第十人民医院
上海
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 复旦大学附属中山医院
上海
复旦大学附属中山医院
上海
第5名 综合排名
 华中科技大学同济医院
武汉
华中科技大学同济医院
武汉
 北京医院
北京
北京医院
北京
第60名 综合排名
 上海交通大学医学院附属仁济医院
上海
上海交通大学医学院附属仁济医院
上海
第17名 综合排名
 浙江省肿瘤医院
杭州
浙江省肿瘤医院
杭州
第8名 肿瘤科排名
 北京京西肿瘤医院
北京
北京京西肿瘤医院
北京
 上海交通大学医学院附属瑞金医院
上海
上海交通大学医学院附属瑞金医院
上海
第4名 综合排名
 上海市胸科医院
上海
上海市胸科医院
上海
第80名 综合排名
 上海新华医院
上海
上海新华医院
上海
 江苏省肿瘤医院
南京
江苏省肿瘤医院
南京
第9名 肿瘤科排名
 中山大学附属第一医院
广州
中山大学附属第一医院
广州
第9名 综合排名
 上海市东方医院
上海
上海市东方医院
上海
 浙大二院
杭州
浙大二院
杭州
 浙江大学医学院附属第一医院
杭州
浙江大学医学院附属第一医院
杭州
第10名 综合排名
 湖北省肿瘤医院
武汉
湖北省肿瘤医院
武汉
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 河南省肿瘤医院
郑州
河南省肿瘤医院
郑州
 武汉大学人民医院
武汉
武汉大学人民医院
武汉
第40名 综合排名
 中国医科大学附属盛京医院
沈阳
中国医科大学附属盛京医院
沈阳
第33名 综合排名
 上海长海医院
上海
上海长海医院
上海
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 浙江大学医学院附属邵逸夫医院
杭州
浙江大学医学院附属邵逸夫医院
杭州
第49名 综合排名
 复旦大学附属华山医院
上海
复旦大学附属华山医院
上海
第8名 综合排名
 广州泰和肿瘤医院
广州
广州泰和肿瘤医院
广州
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 西安交通大学第一附属医院
西安
西安交通大学第一附属医院
西安
第63名 综合排名
 中国科学技术大学附属第一医院
合肥
中国科学技术大学附属第一医院
合肥
第95名 综合排名
 山东大学齐鲁医院
济南
山东大学齐鲁医院
济南
第24名 综合排名
 吉林省肿瘤医院
长春
吉林省肿瘤医院
长春
 辽宁省肿瘤医院
沈阳
辽宁省肿瘤医院
沈阳
 浙江大学医学院附属妇产科医院
杭州
浙江大学医学院附属妇产科医院
杭州
第91名 综合排名
 北部战区总医院
沈阳
北部战区总医院
沈阳
 深圳市第三人民医院
深圳
深圳市第三人民医院
深圳
 山西省肿瘤医院
太原
山西省肿瘤医院
太原
 杭州市肿瘤医院
杭州
杭州市肿瘤医院
杭州
 南京市胸科医院
南京
南京市胸科医院
南京
 中日友好医院
北京
中日友好医院
北京
第43名 综合排名
 福建省肿瘤医院
福州
福建省肿瘤医院
福州
 广东省人民医院
广州
广东省人民医院
广州
第34名 综合排名
 四川省肿瘤医院
成都
四川省肿瘤医院
成都
 中山大学附属第三医院
广州
中山大学附属第三医院
广州
第45名 综合排名
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 西南医院
重庆
西南医院
重庆
 新桥医院
重庆
新桥医院
重庆
 福建医科大学附属第一医院
福州
福建医科大学附属第一医院
福州
第84名 综合排名
 兰州大学第二医院
兰州
兰州大学第二医院
兰州
 广东省中医院
广州
广东省中医院
广州
 山东省立医院
济南
山东省立医院
济南
第52名 综合排名
 武汉大学中南医院
武汉
武汉大学中南医院
武汉
第55名 综合排名
 上海长征医院
上海
上海长征医院
上海
 厦门大学附属第一医院
厦门
厦门大学附属第一医院
厦门
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 重庆医科大学附属第一医院
重庆
重庆医科大学附属第一医院
重庆
第48名 综合排名
 中南大学湘雅二医院
长沙
中南大学湘雅二医院
长沙
第20名 综合排名
 四川省人民医院
成都
四川省人民医院
成都
第38名 综合排名
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 东部战区总医院
南京
东部战区总医院
南京
第58名 综合排名
 中山大学孙逸仙纪念医院
广州
中山大学孙逸仙纪念医院
广州
第64名 综合排名
 哈尔滨医科大学附属第一医院
哈尔滨
哈尔滨医科大学附属第一医院
哈尔滨
第78名 综合排名
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 东南大学附属中大医院
南京
东南大学附属中大医院
南京
第46名 综合排名
 哈尔滨医科大学附属第二医院
哈尔滨
哈尔滨医科大学附属第二医院
哈尔滨
第67名 综合排名
 福建医科大学附属协和医院
福州
福建医科大学附属协和医院
福州
第88名 综合排名
 广州医科大学附属第一医院
广州
广州医科大学附属第一医院
广州
第31名 综合排名
 301医院
北京
301医院
北京
 复旦大学附属妇产科医院
上海
复旦大学附属妇产科医院
上海
第85名 综合排名
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 上海市第十人民医院
上海
上海市第十人民医院
上海
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 复旦大学附属中山医院
上海
复旦大学附属中山医院
上海
第5名 综合排名
 华中科技大学同济医院
武汉
华中科技大学同济医院
武汉
 北京医院
北京
北京医院
北京
第60名 综合排名
 上海交通大学医学院附属仁济医院
上海
上海交通大学医学院附属仁济医院
上海
第17名 综合排名
 浙江省肿瘤医院
杭州
浙江省肿瘤医院
杭州
第8名 肿瘤科排名
 北京京西肿瘤医院
北京
北京京西肿瘤医院
北京
 上海市胸科医院
上海
上海市胸科医院
上海
第80名 综合排名
 湖南省肿瘤医院
长沙
湖南省肿瘤医院
长沙
 上海新华医院
上海
上海新华医院
上海
 江苏省肿瘤医院
南京
江苏省肿瘤医院
南京
第9名 肿瘤科排名
 中山大学附属第一医院
广州
中山大学附属第一医院
广州
第9名 综合排名
 南方医科大学南方医院
广州
南方医科大学南方医院
广州
第18名 综合排名
 上海市东方医院
上海
上海市东方医院
上海
 浙大二院
杭州
浙大二院
杭州
 浙江大学医学院附属第一医院
杭州
浙江大学医学院附属第一医院
杭州
第10名 综合排名
 湖北省肿瘤医院
武汉
湖北省肿瘤医院
武汉
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 河南省肿瘤医院
郑州
河南省肿瘤医院
郑州
 苏州大学附属第一医院
苏州
苏州大学附属第一医院
苏州
第54名 综合排名
 武汉大学人民医院
武汉
武汉大学人民医院
武汉
第40名 综合排名
 中国医科大学附属盛京医院
沈阳
中国医科大学附属盛京医院
沈阳
第33名 综合排名
 上海长海医院
上海
上海长海医院
上海
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 浙江大学医学院附属邵逸夫医院
杭州
浙江大学医学院附属邵逸夫医院
杭州
第49名 综合排名
 复旦大学附属华山医院
上海
复旦大学附属华山医院
上海
第8名 综合排名
 广州泰和肿瘤医院
广州
广州泰和肿瘤医院
广州
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 西安交通大学第一附属医院
西安
西安交通大学第一附属医院
西安
第63名 综合排名
 中国科学技术大学附属第一医院
合肥
中国科学技术大学附属第一医院
合肥
第95名 综合排名
 山东大学齐鲁医院
济南
山东大学齐鲁医院
济南
第24名 综合排名
 辽宁省肿瘤医院
沈阳
辽宁省肿瘤医院
沈阳
 山西省肿瘤医院
太原
山西省肿瘤医院
太原
 新桥医院
重庆
新桥医院
重庆
 浙江大学医学院附属妇产科医院
杭州
浙江大学医学院附属妇产科医院
杭州
第91名 综合排名
 北部战区总医院
沈阳
北部战区总医院
沈阳
 深圳市第三人民医院
深圳
深圳市第三人民医院
深圳
 吉林省肿瘤医院
长春
吉林省肿瘤医院
长春
 杭州市肿瘤医院
杭州
杭州市肿瘤医院
杭州
 中山大学附属第三医院
广州
中山大学附属第三医院
广州
第45名 综合排名
 中日友好医院
北京
中日友好医院
北京
第43名 综合排名
 福建省肿瘤医院
福州
福建省肿瘤医院
福州
 广东省人民医院
广州
广东省人民医院
广州
第34名 综合排名
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 西南医院
重庆
西南医院
重庆
 南京市胸科医院
南京
南京市胸科医院
南京
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 福建医科大学附属第一医院
福州
福建医科大学附属第一医院
福州
第84名 综合排名
 哈尔滨医科大学附属第一医院
哈尔滨
哈尔滨医科大学附属第一医院
哈尔滨
第78名 综合排名
 兰州大学第二医院
兰州
兰州大学第二医院
兰州
 广东省中医院
广州
广东省中医院
广州
 山东省立医院
济南
山东省立医院
济南
第52名 综合排名
 上海长征医院
上海
上海长征医院
上海
 厦门大学附属第一医院
厦门
厦门大学附属第一医院
厦门
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 重庆医科大学附属第一医院
重庆
重庆医科大学附属第一医院
重庆
第48名 综合排名
 武汉大学中南医院
武汉
武汉大学中南医院
武汉
第55名 综合排名
 中南大学湘雅二医院
长沙
中南大学湘雅二医院
长沙
第20名 综合排名
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 东部战区总医院
南京
东部战区总医院
南京
第58名 综合排名
 中山大学孙逸仙纪念医院
广州
中山大学孙逸仙纪念医院
广州
第64名 综合排名
 东南大学附属中大医院
南京
东南大学附属中大医院
南京
第46名 综合排名
 301医院
北京
301医院
北京
 四川省人民医院
成都
四川省人民医院
成都
第38名 综合排名
 哈尔滨医科大学附属第二医院
哈尔滨
哈尔滨医科大学附属第二医院
哈尔滨
第67名 综合排名
 广州医科大学附属第一医院
广州
广州医科大学附属第一医院
广州
第31名 综合排名
 四川省肿瘤医院
成都
四川省肿瘤医院
成都
 复旦大学附属妇产科医院
上海
复旦大学附属妇产科医院
上海
第85名 综合排名
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 上海市第十人民医院
上海
上海市第十人民医院
上海
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 复旦大学附属中山医院
上海
复旦大学附属中山医院
上海
第5名 综合排名
 华中科技大学同济医院
武汉
华中科技大学同济医院
武汉
 北京医院
北京
北京医院
北京
第60名 综合排名
 上海交通大学医学院附属仁济医院
上海
上海交通大学医学院附属仁济医院
上海
第17名 综合排名
 浙江省肿瘤医院
杭州
浙江省肿瘤医院
杭州
第8名 肿瘤科排名
 北京京西肿瘤医院
北京
北京京西肿瘤医院
北京
 上海交通大学医学院附属瑞金医院
上海
上海交通大学医学院附属瑞金医院
上海
第4名 综合排名
 上海市胸科医院
上海
上海市胸科医院
上海
第80名 综合排名
 湖南省肿瘤医院
长沙
湖南省肿瘤医院
长沙
 上海新华医院
上海
上海新华医院
上海
 江苏省肿瘤医院
南京
江苏省肿瘤医院
南京
第9名 肿瘤科排名
 中山大学附属第一医院
广州
中山大学附属第一医院
广州
第9名 综合排名
 南方医科大学南方医院
广州
南方医科大学南方医院
广州
第18名 综合排名
 上海市东方医院
上海
上海市东方医院
上海
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 浙大二院
杭州
浙大二院
杭州
 浙江大学医学院附属第一医院
杭州
浙江大学医学院附属第一医院
杭州
第10名 综合排名
 河南省肿瘤医院
郑州
河南省肿瘤医院
郑州
 武汉大学人民医院
武汉
武汉大学人民医院
武汉
第40名 综合排名
 湖北省肿瘤医院
武汉
湖北省肿瘤医院
武汉
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 浙江大学医学院附属邵逸夫医院
杭州
浙江大学医学院附属邵逸夫医院
杭州
第49名 综合排名
 复旦大学附属华山医院
上海
复旦大学附属华山医院
上海
第8名 综合排名
 广州泰和肿瘤医院
广州
广州泰和肿瘤医院
广州
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 上海长海医院
上海
上海长海医院
上海
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 中国科学技术大学附属第一医院
合肥
中国科学技术大学附属第一医院
合肥
第95名 综合排名
 山东大学齐鲁医院
济南
山东大学齐鲁医院
济南
第24名 综合排名
 吉林省肿瘤医院
长春
吉林省肿瘤医院
长春
 山西省肿瘤医院
太原
山西省肿瘤医院
太原
 新桥医院
重庆
新桥医院
重庆
 浙江大学医学院附属妇产科医院
杭州
浙江大学医学院附属妇产科医院
杭州
第91名 综合排名
 北部战区总医院
沈阳
北部战区总医院
沈阳
 深圳市第三人民医院
深圳
深圳市第三人民医院
深圳
 杭州市肿瘤医院
杭州
杭州市肿瘤医院
杭州
 南京市胸科医院
南京
南京市胸科医院
南京
 中日友好医院
北京
中日友好医院
北京
第43名 综合排名
 福建省肿瘤医院
福州
福建省肿瘤医院
福州
 广东省人民医院
广州
广东省人民医院
广州
第34名 综合排名
 四川省肿瘤医院
成都
四川省肿瘤医院
成都
 中山大学附属第三医院
广州
中山大学附属第三医院
广州
第45名 综合排名
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 哈尔滨医科大学附属第一医院
哈尔滨
哈尔滨医科大学附属第一医院
哈尔滨
第78名 综合排名
 四川大学华西第二医院
成都
四川大学华西第二医院
成都
第70名 综合排名
 广东省中医院
广州
广东省中医院
广州
 上海长征医院
上海
上海长征医院
上海
 厦门大学附属第一医院
厦门
厦门大学附属第一医院
厦门
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 武汉大学中南医院
武汉
武汉大学中南医院
武汉
第55名 综合排名
 中南大学湘雅二医院
长沙
中南大学湘雅二医院
长沙
第20名 综合排名
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 哈尔滨医科大学附属第二医院
哈尔滨
哈尔滨医科大学附属第二医院
哈尔滨
第67名 综合排名
 广州医科大学附属第一医院
广州
广州医科大学附属第一医院
广州
第31名 综合排名
 复旦大学附属妇产科医院
上海
复旦大学附属妇产科医院
上海
第85名 综合排名
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 上海市第十人民医院
上海
上海市第十人民医院
上海
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 复旦大学附属中山医院
上海
复旦大学附属中山医院
上海
第5名 综合排名
 华中科技大学同济医院
武汉
华中科技大学同济医院
武汉
 北京医院
北京
北京医院
北京
第60名 综合排名
 上海交通大学医学院附属仁济医院
上海
上海交通大学医学院附属仁济医院
上海
第17名 综合排名
 浙江省肿瘤医院
杭州
浙江省肿瘤医院
杭州
第8名 肿瘤科排名
 北京京西肿瘤医院
北京
北京京西肿瘤医院
北京
 上海交通大学医学院附属瑞金医院
上海
上海交通大学医学院附属瑞金医院
上海
第4名 综合排名
 上海市胸科医院
上海
上海市胸科医院
上海
第80名 综合排名
 湖南省肿瘤医院
长沙
湖南省肿瘤医院
长沙
 江苏省肿瘤医院
南京
江苏省肿瘤医院
南京
第9名 肿瘤科排名
 中山大学附属第一医院
广州
中山大学附属第一医院
广州
第9名 综合排名
 南方医科大学南方医院
广州
南方医科大学南方医院
广州
第18名 综合排名
 上海市东方医院
上海
上海市东方医院
上海
 湖北省肿瘤医院
武汉
湖北省肿瘤医院
武汉
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 河南省肿瘤医院
郑州
河南省肿瘤医院
郑州
 苏州大学附属第一医院
苏州
苏州大学附属第一医院
苏州
第54名 综合排名
 武汉大学人民医院
武汉
武汉大学人民医院
武汉
第40名 综合排名
 中国医科大学附属盛京医院
沈阳
中国医科大学附属盛京医院
沈阳
第33名 综合排名
 中国医科大学附属第一医院
沈阳
中国医科大学附属第一医院
沈阳
第16名 综合排名
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 复旦大学附属华山医院
上海
复旦大学附属华山医院
上海
第8名 综合排名
 广州泰和肿瘤医院
广州
广州泰和肿瘤医院
广州
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 上海长海医院
上海
上海长海医院
上海
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 西安交通大学第一附属医院
西安
西安交通大学第一附属医院
西安
第63名 综合排名
 中国科学技术大学附属第一医院
合肥
中国科学技术大学附属第一医院
合肥
第95名 综合排名
 山东大学齐鲁医院
济南
山东大学齐鲁医院
济南
第24名 综合排名
 吉林省肿瘤医院
长春
吉林省肿瘤医院
长春
 辽宁省肿瘤医院
沈阳
辽宁省肿瘤医院
沈阳
 山西省肿瘤医院
太原
山西省肿瘤医院
太原
 新桥医院
重庆
新桥医院
重庆
 浙江大学医学院附属妇产科医院
杭州
浙江大学医学院附属妇产科医院
杭州
第91名 综合排名
 北部战区总医院
沈阳
北部战区总医院
沈阳
 深圳市第三人民医院
深圳
深圳市第三人民医院
深圳
 杭州市肿瘤医院
杭州
杭州市肿瘤医院
杭州
 南京市胸科医院
南京
南京市胸科医院
南京
 中日友好医院
北京
中日友好医院
北京
第43名 综合排名
 福建省肿瘤医院
福州
福建省肿瘤医院
福州
 广东省人民医院
广州
广东省人民医院
广州
第34名 综合排名
 四川省肿瘤医院
成都
四川省肿瘤医院
成都
 中山大学附属第三医院
广州
中山大学附属第三医院
广州
第45名 综合排名
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 西南医院
重庆
西南医院
重庆
 福建医科大学附属第一医院
福州
福建医科大学附属第一医院
福州
第84名 综合排名
 哈尔滨医科大学附属第一医院
哈尔滨
哈尔滨医科大学附属第一医院
哈尔滨
第78名 综合排名
 兰州大学第二医院
兰州
兰州大学第二医院
兰州
 四川大学华西第二医院
成都
四川大学华西第二医院
成都
第70名 综合排名
 广东省中医院
广州
广东省中医院
广州
 山东省立医院
济南
山东省立医院
济南
第52名 综合排名
 上海长征医院
上海
上海长征医院
上海
 厦门大学附属第一医院
厦门
厦门大学附属第一医院
厦门
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 重庆医科大学附属第一医院
重庆
重庆医科大学附属第一医院
重庆
第48名 综合排名
 武汉大学中南医院
武汉
武汉大学中南医院
武汉
第55名 综合排名
 中南大学湘雅二医院
长沙
中南大学湘雅二医院
长沙
第20名 综合排名
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 东部战区总医院
南京
东部战区总医院
南京
第58名 综合排名
 中山大学孙逸仙纪念医院
广州
中山大学孙逸仙纪念医院
广州
第64名 综合排名
 东南大学附属中大医院
南京
东南大学附属中大医院
南京
第46名 综合排名
 301医院
北京
301医院
北京
 四川省人民医院
成都
四川省人民医院
成都
第38名 综合排名
 哈尔滨医科大学附属第二医院
哈尔滨
哈尔滨医科大学附属第二医院
哈尔滨
第67名 综合排名
 福建医科大学附属协和医院
福州
福建医科大学附属协和医院
福州
第88名 综合排名
 广州医科大学附属第一医院
广州
广州医科大学附属第一医院
广州
第31名 综合排名
 复旦大学附属妇产科医院
上海
复旦大学附属妇产科医院
上海
第85名 综合排名
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 上海市第十人民医院
上海
上海市第十人民医院
上海
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 复旦大学附属中山医院
上海
复旦大学附属中山医院
上海
第5名 综合排名
 华中科技大学同济医院
武汉
华中科技大学同济医院
武汉
 北京医院
北京
北京医院
北京
第60名 综合排名
 上海交通大学医学院附属仁济医院
上海
上海交通大学医学院附属仁济医院
上海
第17名 综合排名
 浙江省肿瘤医院
杭州
浙江省肿瘤医院
杭州
第8名 肿瘤科排名
 北京京西肿瘤医院
北京
北京京西肿瘤医院
北京
 上海交通大学医学院附属瑞金医院
上海
上海交通大学医学院附属瑞金医院
上海
第4名 综合排名
 上海市胸科医院
上海
上海市胸科医院
上海
第80名 综合排名
 湖南省肿瘤医院
长沙
湖南省肿瘤医院
长沙
 上海新华医院
上海
上海新华医院
上海
 江苏省肿瘤医院
南京
江苏省肿瘤医院
南京
第9名 肿瘤科排名
 中山大学附属第一医院
广州
中山大学附属第一医院
广州
第9名 综合排名
 南方医科大学南方医院
广州
南方医科大学南方医院
广州
第18名 综合排名
 上海市东方医院
上海
上海市东方医院
上海
 浙大二院
杭州
浙大二院
杭州
 浙江大学医学院附属第一医院
杭州
浙江大学医学院附属第一医院
杭州
第10名 综合排名
 湖北省肿瘤医院
武汉
湖北省肿瘤医院
武汉
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 河南省肿瘤医院
郑州
河南省肿瘤医院
郑州
 苏州大学附属第一医院
苏州
苏州大学附属第一医院
苏州
第54名 综合排名
 武汉大学人民医院
武汉
武汉大学人民医院
武汉
第40名 综合排名
 中国医科大学附属盛京医院
沈阳
中国医科大学附属盛京医院
沈阳
第33名 综合排名
 中国医科大学附属第一医院
沈阳
中国医科大学附属第一医院
沈阳
第16名 综合排名
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 浙江大学医学院附属邵逸夫医院
杭州
浙江大学医学院附属邵逸夫医院
杭州
第49名 综合排名
 复旦大学附属华山医院
上海
复旦大学附属华山医院
上海
第8名 综合排名
 广州泰和肿瘤医院
广州
广州泰和肿瘤医院
广州
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 上海长海医院
上海
上海长海医院
上海
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 淫羊藿素软胶囊纳入2023版国家医保目录
淫羊藿素软胶囊纳入2023版国家医保目录
 国内首个!阿可拉定获批肝癌一线,中药治疗晚期肝癌初露锋芒...
国内首个!阿可拉定获批肝癌一线,中药治疗晚期肝癌初露锋芒...
 超6亿美元!恒瑞医药抗PD-1单抗组合疗法(卡瑞利珠单抗与阿帕替尼)肝...
超6亿美元!恒瑞医药抗PD-1单抗组合疗法(卡瑞利珠单抗与阿帕替尼)肝...
 多纳非尼纳入《肝癌术后辅助治疗中国专家共识(2023版)》...
多纳非尼纳入《肝癌术后辅助治疗中国专家共识(2023版)》...
 FDA批准 Keytruda (帕博利珠单抗 ) 用于治疗先前接受过索拉非尼...
FDA批准 Keytruda (帕博利珠单抗 ) 用于治疗先前接受过索拉非尼...
 卡瑞利珠单抗联合阿帕替尼一线治疗肝细胞癌获批上市...
卡瑞利珠单抗联合阿帕替尼一线治疗肝细胞癌获批上市...
 病例分享:佩米替尼联合免疫治疗成功实现肝内胆管癌术前转化...
病例分享:佩米替尼联合免疫治疗成功实现肝内胆管癌术前转化...
 ESMO中国之声丨赵明教授:度伐利尤单抗联合HAIC在肝癌治疗中的阶段...
ESMO中国之声丨赵明教授:度伐利尤单抗联合HAIC在肝癌治疗中的阶段...
 秦叔逵教授团队:肝癌患者新疗法,中位OS达9.1个月 | 《柳叶刀》子刊...
秦叔逵教授团队:肝癌患者新疗法,中位OS达9.1个月 | 《柳叶刀》子刊...
 一线治疗肝癌!阿斯利康公布抗CTLA-4单抗/抗PD-L1单抗亚洲数据...
一线治疗肝癌!阿斯利康公布抗CTLA-4单抗/抗PD-L1单抗亚洲数据...
 长生存+高缓解!"免疫双子星"治疗肝癌一线CheckMate-9DW数据重磅...
长生存+高缓解!"免疫双子星"治疗肝癌一线CheckMate-9DW数据重磅...
 ILCA 2023 | R-EVOLUTION试验证实雷莫西尤单抗在晚期肝癌序贯治...
ILCA 2023 | R-EVOLUTION试验证实雷莫西尤单抗在晚期肝癌序贯治...
搜索结果
肝癌药物分类
 我国肝癌5年生存率仅为 12.1%!肝癌为什么这么难治?...
我国肝癌5年生存率仅为 12.1%!肝癌为什么这么难治?...
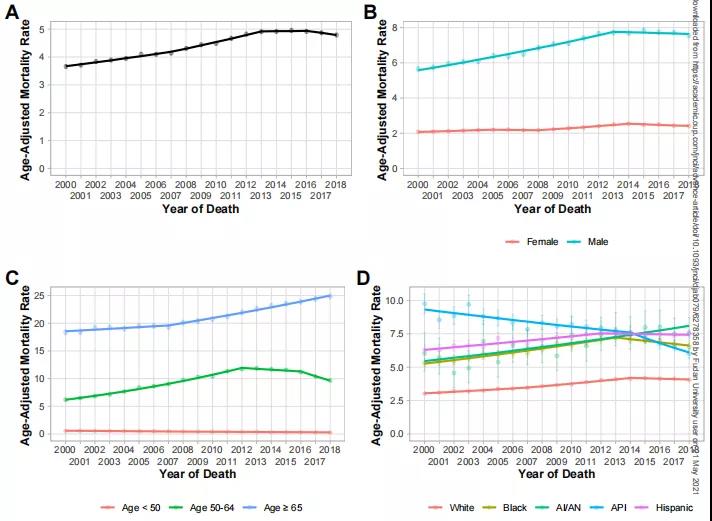 近20年来,肝癌的生存率和死亡率都是怎么样的?...
近20年来,肝癌的生存率和死亡率都是怎么样的?...
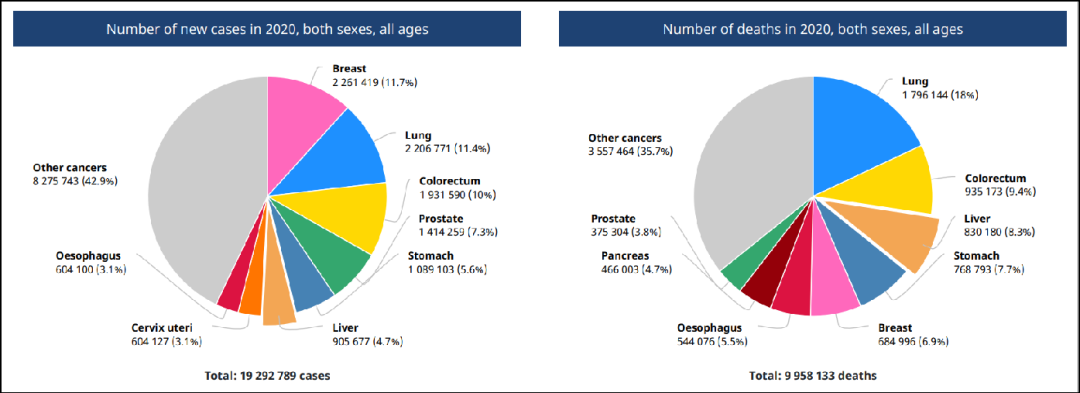
 肝癌的流行病学现状
肝癌的流行病学现状
 科普患教 | 同样都叫肝癌,差别咋这么大咧!
科普患教 | 同样都叫肝癌,差别咋这么大咧!
 【科普】这篇全是“肝货”,请关注!
【科普】这篇全是“肝货”,请关注!
 大明白:肝癌的江湖史
大明白:肝癌的江湖史
 一图读懂:战胜肝癌的十大法宝
一图读懂:战胜肝癌的十大法宝
 如何选择手术治疗还是药物治疗?免疫治疗对哪类肝癌比较有效?...
如何选择手术治疗还是药物治疗?免疫治疗对哪类肝癌比较有效?...
 门静脉癌栓严重影响肝癌患者生存期!超过一半的患者需要注意这个问...
门静脉癌栓严重影响肝癌患者生存期!超过一半的患者需要注意这个问...
其他热门专题
 如何预防和治疗肝癌切除术后复发?
如何预防和治疗肝癌切除术后复发?
 如何降低肝癌术后高复发率?——王葵教授分享防治新策略...
如何降低肝癌术后高复发率?——王葵教授分享防治新策略...
 肝癌术后甲胎蛋白等癌症指标持续上升是否考虑复发?...
肝癌术后甲胎蛋白等癌症指标持续上升是否考虑复发?...
 为什么我国肝癌患者容易复发转移?
为什么我国肝癌患者容易复发转移?
 黎功主任:肝癌手术后复发了怎么办?
黎功主任:肝癌手术后复发了怎么办?
 警惕肝癌三个转移途径
警惕肝癌三个转移途径
 快点拿起“武器”,消灭“落单”的它~
快点拿起“武器”,消灭“落单”的它~
其他热门专题
 体检发现脂肪肝,有可能逆转吗?
体检发现脂肪肝,有可能逆转吗?
 脂肪肝可能直接变成肝癌,1.2亿人处于危险边缘!4大“秘籍”,不吃药也...
脂肪肝可能直接变成肝癌,1.2亿人处于危险边缘!4大“秘籍”,不吃药也...
 中国人群大型研究:长期接触空气污染,容易得脂肪肝?这几类人尤其要注...
中国人群大型研究:长期接触空气污染,容易得脂肪肝?这几类人尤其要注...
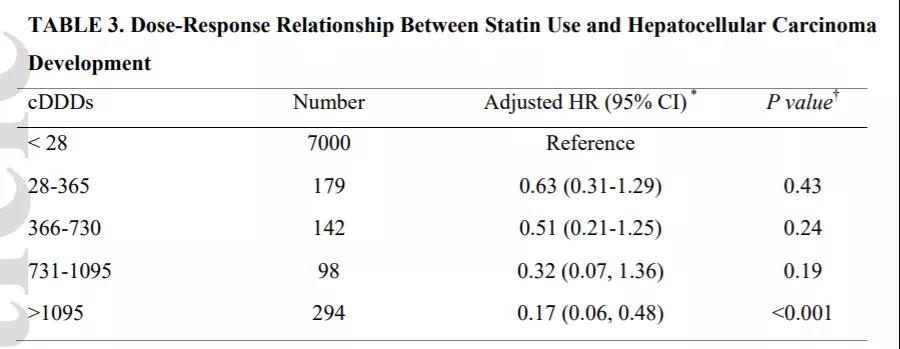 他汀类药物预防或可降低慢乙肝的肝癌风险
他汀类药物预防或可降低慢乙肝的肝癌风险
 乙肝患者该如何预防肝癌?
乙肝患者该如何预防肝癌?
 【健康科普】感染HBV就能导致肝癌吗?
【健康科普】感染HBV就能导致肝癌吗?
 黄曲霉素 诱发肝癌的元凶之一
黄曲霉素 诱发肝癌的元凶之一
 科普患教 | 吃鱼生为何成了肝癌高危人群?
科普患教 | 吃鱼生为何成了肝癌高危人群?
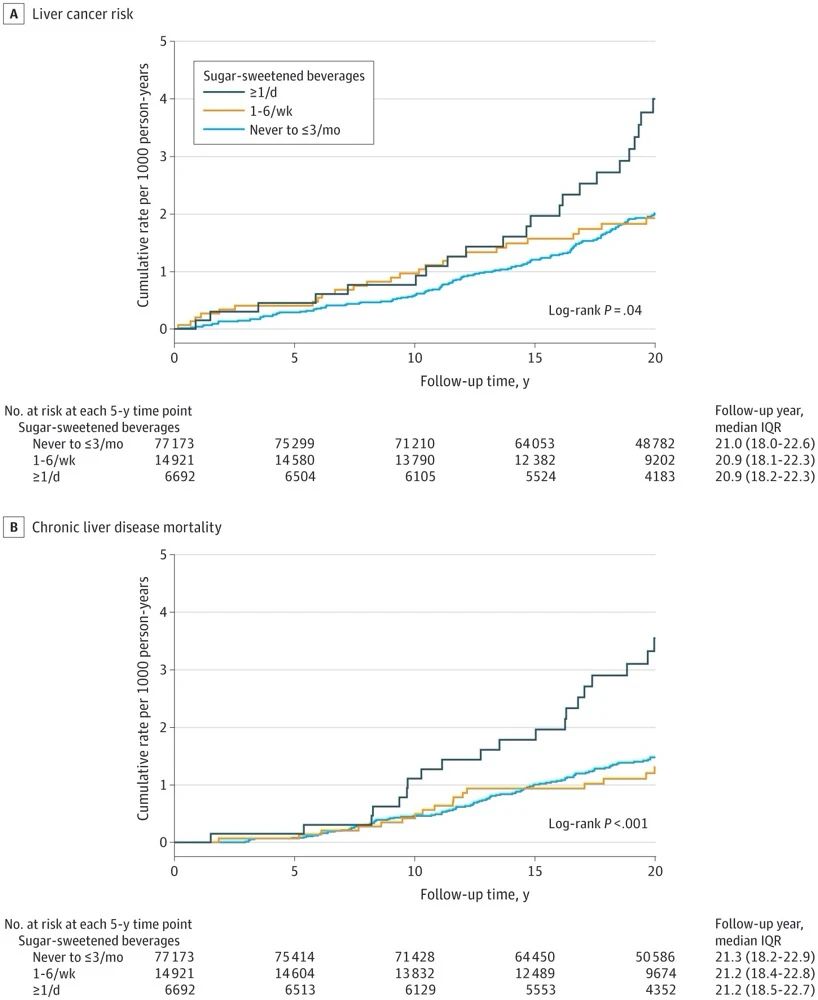 含糖饮料成为增加肝癌发病率和慢性肝病相关死亡率的黑夜杀手...
含糖饮料成为增加肝癌发病率和慢性肝病相关死亡率的黑夜杀手...
 出现这些症状可能是肝癌!每天吃点洋葱,肝癌风险降低33%...
出现这些症状可能是肝癌!每天吃点洋葱,肝癌风险降低33%...
 预防肝癌,请记住这几点
预防肝癌,请记住这几点
其他热门专题
 肝癌破裂出血处理的注意事项
肝癌破裂出血处理的注意事项
 肝癌合并消化道出血的预防和管理
肝癌合并消化道出血的预防和管理
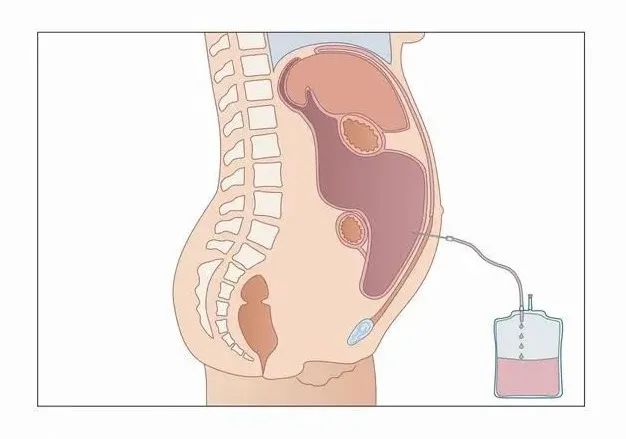 肿瘤患者,如何应对“腹水”?
肿瘤患者,如何应对“腹水”?
其他热门专题









